
3.1.1.1 平均速率
通常所说的化学反应速率(rate of reaction)是指在一定条件下,参加反应的各物质的浓度随时间的变化率,用单位时间内反应物浓度的减少或生成物浓度的增加来表示,称之为平均速率,用符号v表示。浓度的单位通常用mol·L-1,时间单位通常用秒(s)、分(min)或时(H)等来表示。这样反应速率的单位通常是:mol·L-1·s-1,mol·L-1·min-1,mol·L-1·h-1等。
例如对于一般的化学反应:aA+bB→gG+hH
用反应物A浓度的减少表示的平均速率为:
用生成物G浓度的增加表示的平均速率为:
在上面两式中,由于反应物随反应的进行浓度减少,所以Δc为负值,计算时前面要加负号;而生成物浓度增加,故Δc为正值,计算时前面为正号,以保证反应速率为正值。
如以H2O2在l-作用下分解反应为例:
用反应物H2O2浓度变化所表示的平均速率如表3.1所示。
表3.1 H2O2溶液浓度随时间关系
从表3.1可以看出,平均速率来表示同一反应的反应速率,在不同时间段反应的平均速率并不相同。
3.1.1.2 瞬时速率
反应的瞬时速率更能真实地表示反应进行到t时刻的反应速率情况。瞬时速率为Δt趋于0时浓度对时间的变化率。对于上面的一般反应,生成物G的瞬时生成速率为:
如果以生成物浓度随时间变化来做一条曲线的话,t时刻的瞬时速率为其所对应的曲线上该点的斜率,如图3.1所示。
用不同物质所表示的瞬时速率存在如下关系:
显然,当反应物和生成物的系数不等时,用反应物或生成物浓度表示同一反应的瞬时速率其值也不同。
3.1.1.3 用反应进度表示的反应速率
对于上述的一般反应,可以写成计量式:
式中的νB为物质B的化学计量数。对于反应物,νB为负值;对于生成物,νB为正值。
按国际纯粹与应用化学联合会(IUPAC)推荐,把单位体积内反应进行程度随时间的变化率定义为化学反应速率,即
式中,V为系统的体积,ξ为反应进度。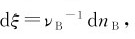 nB为物质B的物质的量,因此式(3.4)又可以写成:
nB为物质B的物质的量,因此式(3.4)又可以写成:
对于恒容反应(V不变),dnB/V=dcB,则式(3.4)又可写为
式中的v表示的是整个反应的反应速率。显然,用反应进度定义的反应速率与表示速率的物质选择无关,即一个反应在某一时刻只有一个反应速率。当然,因为反应进度和化学计量系数及反应方程式的写法有关,因此v和反应方程式的写法也有关。







