
实验17 免疫印迹技术
(Immunoblotting)
【目的】
了解并掌握免疫印迹实验的原理、方法及主要用途。
【原理】
免疫印迹或免疫转印技术(immunoblotting或Western blot)是在Southern(1975)创建的DNA印迹术(Southern blotting)基础上发展起来的一种新型免疫生化技术。其基本原理是蛋白质样品经过SDS-PAGE分离后,通过转移电泳或直接印迹方式原位转印至固相介质上,并保持其原有的物质类型和生物学活性不变,然后应用抗原-抗体反应进行特异性检测。
免疫印迹技术包括三个主要部分:①蛋白质的分离;②蛋白质的转移;将已分离的蛋白多肽转移至固相介质上;③免疫学检测,应用抗原-抗体反应对样品进行特异性分析鉴定。
一、蛋白质的分离
十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),将强阴离子去污剂SDS与二巯基乙醇并用,通过加热使蛋白质解离变性,变性的多肽与SDS结合并因此带负电荷,由于与肽结合SDS的量几乎与多肽的分子量成正比而与其序列无关,因此,SDS多肽复合物在聚丙烯酰胺凝胶电泳中的迁移只与多肽的大小有关,在达到饱和的状态下,每克多肽可结合1.4g去污剂,借助已知分子量的标准参照物,则可测算出多肽的分子量。
二、蛋白质转移电泳
转移电泳是将经过SDS-PAGE分离后的蛋白多肽带原位、精确地转印至固相介质如NC膜,并保持其原有物质类型和生物学活性,以利于进一步分析与鉴定。由于转移的蛋白分子多位于固相膜的表面,因此检测十分简便,可进行一些在凝胶上难以甚至不可能进行的试验,以取得定位、定性和定量等直观资料。转移电泳使用低压大电流电泳仪,因此电泳过程需在低温条件下(4~6℃)进行。
三、免疫学检测
免疫印迹技术的主要特点是可以利用抗原-抗体反应对检品进行特异组分的分析和鉴定。常用的固相免疫检测法有放射自显影法、酶免疫测定法(EIA)及免疫荧光法(FIA)等。其中以酶免疫测定法应用较广,因其灵敏、快速、简便易行。目前大多采用酶标记抗体间接染色法,其大致步骤是将转印后的NC膜先与第一抗体共育,洗涤后,再与酶标记的第二抗体(抗抗体)共育,洗涤后,浸于底物溶液中显色。
【材料】
1.试剂: 30%丙烯酰胺储存液、1.5mol/L pH 8.8 Tris-HCl分离胶缓冲液、0.5mol/L pH 6.8 Tris-HCl浓缩胶缓冲液、四甲基乙二胺、10%过硫酸铵溶液、0.025mol/L pH 8.3 Tris-甘氨酸电泳缓冲液、转移缓冲液、洗涤缓冲液、溴酚蓝、考马斯亮蓝、冰醋酸、甲醇、牛血清白蛋白、底物缓冲液。
2.仪器:电泳仪、垂直电泳槽、转移电泳槽、NC膜。
【方法】
1.制胶:将洗涤干净的模具装好,检查有无渗漏,按需要的浓度(表17-1和表17-2)制备分离胶和浓缩胶,先将分离胶注入模具,待其凝聚后再浇入浓缩胶。
表17-1 10%分离胶制备

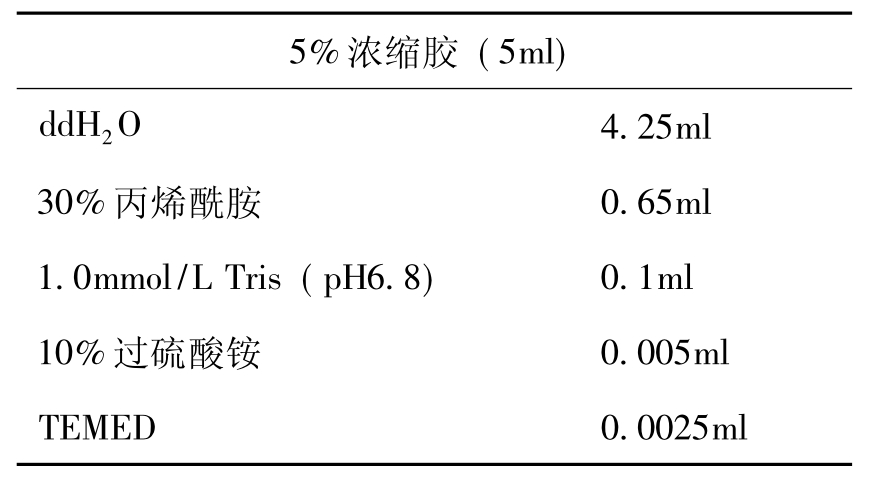
表17-2 5%浓缩胶制备
2.样品处理:将样品经样品处理液适当稀释,沸水加热2~3min,加样量一般每个样品池10~40μl。
3.电泳:下槽正极,上槽负极,起始电流10mA/板,待样品全部进入浓缩胶后增大到20mA/板,待指示剂到达凝胶底部,结束电泳。
4.凝胶染色: 0.2%考马斯亮蓝染色3~4h,用脱色液脱色至背景清晰为止。
5.转移电泳:凝胶电泳结束前30min,将NC膜浸泡在转移缓冲液中。从模具中取出凝胶放在NC膜上,驱除气泡,然后置于滤纸上并放入转移模具中,将模具放入转移电泳槽,NC膜一面朝正极,恒压50V,4℃电泳过夜,次日取出NC膜做好标记,用洗涤缓冲液洗涤10min,共3次,自然干燥,密封保存。
6.抗原-抗体特异性检测。
将NC膜置封闭液中阻断非特异性结合部位后,与一抗37℃保温1h,洗涤10min,共3次,再加入酶标记的二抗,37℃1h,洗涤同前,加入底物溶液显色5~15min,蒸馏水反复洗涤,终止反应。
【结果】
阳性反应呈棕色条带。
【思考题】
试述免疫印迹技术的原理和主要操作步骤。
上一篇:果断的性格对人的一生尤为重要
下一篇:“玫瑰圣母玛丽亚”事件





.jpg)
.jpg)
