
8.4.2 分散度对溶解度的影响和溶液的过饱和现象
分散度与溶解度的关系可以近似用Kelvin公式表示。这里在溶液结晶的情况下,可以用活度比ar/a来代表Pr/P0,ar与a分别为溶液饱和了曲率半径为r的微小晶体与大晶体时溶质的活度,如为稀溶液,活度可用浓度代替,故得下式:
![]()
式中Cr为曲率半径相当于r的微小晶体的溶解度;C为大晶体的溶解度;ρ为晶体的密度;M为溶质的摩尔质量;σ晶-液为晶体与液体界面上的界面张力。上式表明:微小晶体的溶解度大于大晶体的溶解度。该结论同样可用蒸气压曲线来定性说明,如图8-8所示。
图中曲线AO表示大晶体的蒸气压随温度而变化的关系,曲线BD则表示微小晶体的蒸气压随温度而变化的关系;曲线1、2、3、4则分别表示不同浓度(浓度为:4>3>2>1)溶液的蒸气压随温度而变化的关系。在某一温度时,曲线AO和BD分别与某一浓度溶液的蒸气压曲线相交,此时该浓度溶液与晶体呈平衡,故对应的浓度就是晶体在温度t时的溶解度。显然若曲线BD离开曲线AO越远,也就是晶体越小,则相应于交点时该物质的溶解度越大,如果在饱和溶液中有大小不同的晶体,则由于微小晶体比大晶体的溶解度大,所以微小晶体要溶解,而较大晶体就会自动长大。在感光乳剂的成熟过程中,就应用了此原理使卤化银颗粒变得大而均匀,提高感光性能。
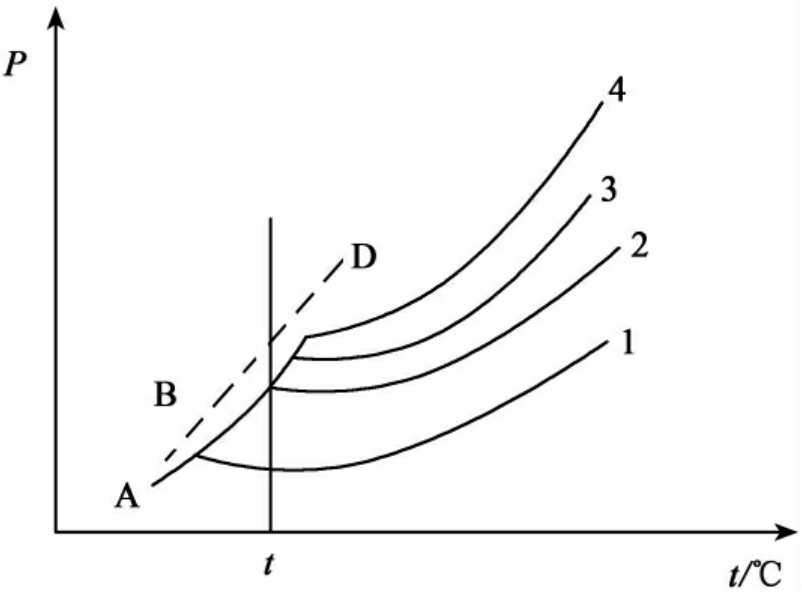
图8-8 分散度对溶解度的影响
在一定条件下,晶体的颗粒愈小,其溶解度愈大。所以将溶液进行恒温蒸发时,溶质的浓度逐渐加大,达到普通晶体溶质的饱和浓度时,对微小晶体的溶质却仍未达到饱和状态,不可能有微小晶体析出。为了使微小晶体能自动生成,需要将溶液进一步蒸发达到一定的过饱和程度,晶体才可能不断地析出。这种按相平衡的条件应有晶体析出而未析出的溶液,称为过饱和溶液。
上述各种饱和状态下的物系(过饱和溶液、过冷液体、过饱和蒸气、过热液体)都不是处于真正的平衡状态,从热力学的观点讲,都是不稳定的,常称为亚稳(或介安)状态,不过它也能维持相当长时间不变,其原因正是因为新相种子难以生成造成的。
上一篇:长寿之神——丹顶鹤







