
(一)物质的量
物质的量与质量、时间、长度、温度等一样,是国际单位制(SI)7个基本物理量之一,是衡量物质所含微粒多少的物理量,物质的量用符号“n”表示。某物质基本单元B的物质的量可表示为nB或n(B)。例如:
氢原子的物质的量可表示为nH或n(H);
氢离子的物质的量可表示为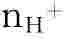 或n(H+);
或n(H+);
氢分子的物质的量可表示为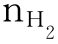 或n(H2)。
或n(H2)。
物质的基本单元可以是原子、离子、分子等粒子,根据需要,物质的基本单元也可以是某些粒子的特定组合。“物质的量”是个物理量,是特定的专有名词,不能拆开理解。
(二)摩尔──物质的量的单位
1971年第14届国际计量大会通过决议,规定物质的量的单位是摩尔,符号mol,简称摩。
摩尔一词来源于拉丁文moles,原意为大量和堆集的意思。科学上应用0.012kg12C(即12g12C)来衡量碳原子集体。经实验测定,12g12C中所含的原子数目约为6.02×1023个,这个数值最先是由意大利科学家阿佛加德罗测定的,故称为阿佛加德罗常数,用符号NA表示,NA=6.02×1023/mol。
由摩尔的定义可知:
1molH含有6.02×1023个氢原子;
1molH+含有6.02×1023个氢离子;
1molO2含有6.02×1023个氧分子;
1molH2O含有6.02×1023个水分子;
即1mol任何物质都含有6.02×1023个基本单元。继而得出:
0.5molH+含有0.5×6.02×1023个氢离子;
2molH+含有2×6.02×1023个氢离子;
物质的量(n)是与物质基本单元数(N)成正比的物理量,它们之间的关系如下。

从N=nNA可以推知:物质的量相等的任何物质,它们所含的基本单元数(微粒数)一定相同;若要比较几种物质所含基本单元数目的大小,只需比较它们的物质的量的多少即可。物质的量这个物理量只适用于微观粒子,使用摩尔作单位时,所指粒子必须十分准确,且粒子的种类要用化学式表示。可以是分子、原子、离子、电子及其他粒子,或这些粒子的特定组合。如:n(H)、n(H2)、n(H2O)、n(H2SO4)等。例如:我们只能说1mol氢原子、1mol氢离子或1mol氢分子,笼统地说1mol氢是不准确的。
上一篇:我国汽车销量与保有量分析预测
下一篇:分析焊接热影响区的组织和性能







