
急性白血病正确分型对临床治疗、预后判断、疗效观察均十分重要。由于免疫学、细胞遗传学和分子生物学技术的发展,在FAB形态学分型的基础上,目前提出了MICM(morphological,immunological,cytogenetics,molecular biology,MICM)分型方案,使白血病的诊断从细胞形态水平上升到亚细胞水平、分子水平,对进一步了解白血病的发病机制和生物学特性,以及指导临床治疗、预后判断有现实意义。现将有关FAB形态学分型、免疫学分型、细胞遗传学分型、分子生物学分型和WHO分型分别进行叙述。
(一)FAB形态学分型
1976年法国(F)、美国(A)、英国(B)协作组提出了FAB的形态学分型方案和诊断标准,规定原始细胞≥30%为急性白血病诊断标准,根据原始细胞类型分为急性淋巴细胞白血病(ALL)和急性髓细胞白血病(AML)或急性非淋巴细胞白血病(ANLL)两大类及亚型,并于1985年和1991年作了修改和增补,现得到广泛应用。我国在FAB分型的基础上,结合国内的特点制定了我国急性白血病的分型标准具体见表11-1。
FAB分型标准明确,是诊断急性白血病的基本方法,但由于白血病细胞形态异质性和多态性,以及形态学分型存在主观性,因此对白血病诊断符合率较低,只有64%~77%,若增加细胞化学染色,则符合率可提高至87%;另外,它不能充分反映白血病的生物学本质。
表11-l 根据FAB分型特点结合国内情况确定的急性白血病分型标准

(续 表)
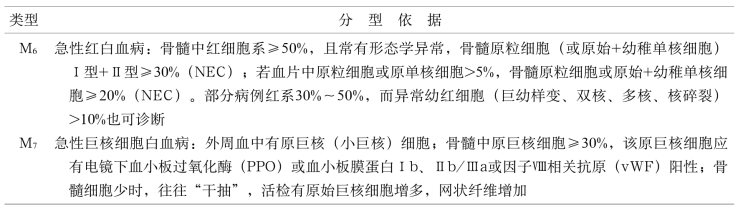
(1)FAB分型原始细胞比例为90%;NEC为非红细胞计数:指不包括所有有核红细胞、浆细胞、淋巴细胞、组织嗜碱细胞、巨噬细胞的骨髓有核细胞计数
链接 原始细胞≥30%为急性白血病诊断标准,但实际应用时应注意,在诊断急?性淋巴细胞白血病时,它包括原淋+幼淋;在诊断急性单核细胞白血病或急性粒-单核细胞白血病时,它包括原单+幼单;另外,在诊断AML-M2b型和AML-M3型时,原始细胞比例不一定≥30%。?
(二)免疫学分型
血细胞在分化成熟为不同谱系、不同阶段的过程中,在细胞质或细胞膜表面会出现不同的白细胞分化抗原,利用单克隆抗体进行测定,可帮助识别细胞类别。利用细胞免疫标记可区分98%以上ALL和AML,并能进一步鉴定其亚型和混合细胞白血病,提高了急性白血病诊断的准确性,是细胞形态学分型的极好补充。由于白血病细胞的异质性和发育非同步性,在分化抗原表达上会出现紊乱和差异,如在T淋巴细胞表达的CD7,与急性髓细胞性白血病有5%~10%的交叉反应,故只表达CD7不能确诊T-ALL;T淋巴细胞表达CD5与部分B淋巴细胞也有交叉反应;少数AML也可表达淋巴细胞系相关抗原,如CD2、CD4、CD7、CD10等,而且阳性者预后较差。故免疫标记在诊断白血病时,须结合形态学、细胞化学等相关信息综合运用。常用于急性白血病分型的单克隆抗体见表11-2。
表11-2 急性白血病分型常用单克隆抗体

cy:表示胞质表达;TdT:末端脱氧核苷转移酶
根据细胞形态学和免疫学特点,ALL和AML的有关分型如下。
1.ALL免疫分型 ALL分为T细胞系和B细胞系,T细胞系ALL约占急淋的20%,可分为2个亚型,见表11-3。B细胞系ALL约占急淋80%,可分为4个亚型,见表11-4。
2.AML免疫分型 研究表明,抗髓过氧化物酶(MPO)单抗为AML特有,MPO和CD117对髓系细胞的特异性和敏感性比CD13、CD33更好;CD14与单核细胞白血病有关。CD34为造血干细胞标志,与低分化的AML相关,在M0、M1和M5a中有较高表达。CD13阳性者预后较差,生存期短。具体AML免疫学标志以及与FAB分型的关系见表11-5。
表11-3 急性T淋巴细胞白血病MICM分型

表11-4 急性B淋巴细胞白血病MICM分型
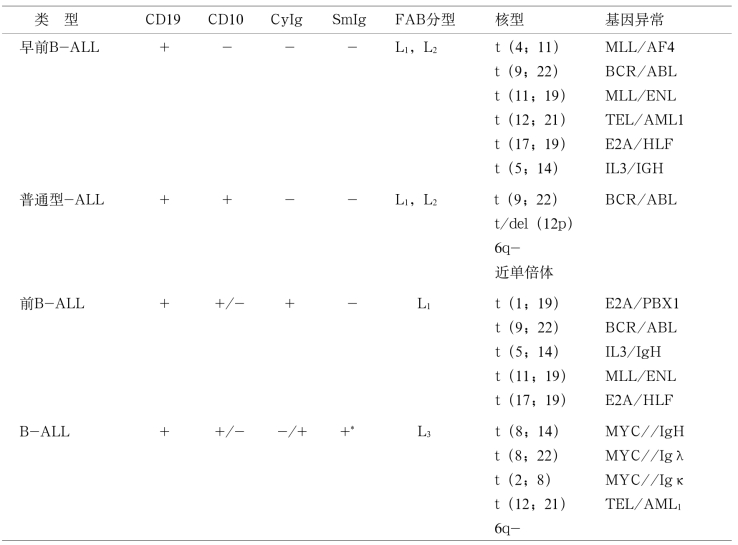
* 单轻链
表11-5 急性髓系细胞白血病免疫学标志与FAB分型
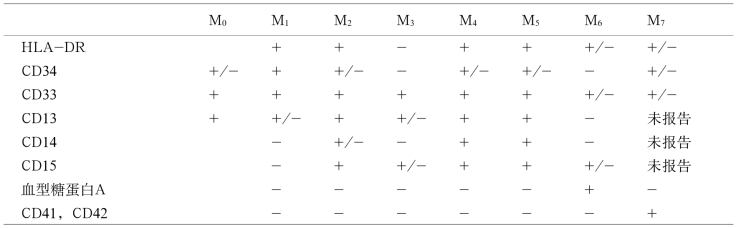
(三)细胞遗传学分型
细胞染色体分析是研究和诊断白血病的重要方法之一。随着细胞培养和染色体分带技术不断提高,染色体异常检出率增高,白血病与克隆性染色体异常的关系越来越明显。AML时染色体核型异常分为两类,一类是与FAB分型不相关的,表现为随机性和非特异性,多数为数目异常,表现为整条或部分染色体丢失或增加,如+8,+21,-5/del(5q-),-7/del(7q)。另一类与FAB分型相关的特异性染色体结构重排,占60%左右,主要表现相互易位或倒位,并产生融合基因(表11-6)。ALL可检出90%以上染色体克隆性异常,多数为特异性染色体重排,并与其免疫分型有关,参见表11-3和表11-4。
白血病细胞遗传学改变与化疗效果及预后有关,如AML-M3型存在染色体t(15;17)(q22;q12),产生PML/RARα融合基因者,用全反式维甲酸治疗,缓解率高,预后良好。在AML时,预后较好的染色体易位有t(8;21)、t(15;17)和inv(16);而预后较差有t/del(11q23)、t(6;9)、t(9;22)等。另外,特异性染色体异常消失或重新出现可作为病情缓解和复发的观察指标。
(四)分子生物学分型
在某些白血病患者染色体之间发生易位后,出现了基因重排,形成各种融合基因。有些染色体分子水平改变,与白血病发病机制有关,且在疾病过程中比较稳定,是可靠的特异性分子标志,例如:特异性免疫球蛋白重链和轻链基因重排,可作为B-ALL特异性克隆分子基因标志,并用于分型。T细胞受体γ和δ基因重排见于所有T-ALL、50%B-ALL,而AML中极少出现。90%以上的AML-M3型有t(15;17)(q22;q12),并产生PML/RARα融合基因,少数患者虽然未能检出t(15;17)(q22;q12),但可发现PML/RARα融合基因存在,说明融合基因检测比染色体检查更敏感和更有特异性。AML具体分子生物学分型(表11-6)。
(五)WHO急性白血病分型
2001年WHO应用MICM分型技术,在FAB形态学分型的基础上,结合临床,提出了新的造血和淋巴组织肿瘤分型方案,并在2008年进行了修订,首先对急性白血病诊断标准进行了修改,①血或骨髓原粒(原单)细胞≥20%可诊断AML,则由原来的30%下降至20%;②当骨髓原始细胞<20%时,但伴有重现性遗传学异常,如t(8;21)(q22;q22)、t(15;17)(q22;q12)和inv(16)(P13;q22)、t(16;16)(p13;q22)等,也可诊断为AML;③骨髓中幼稚淋巴细胞>25%可诊断ALL。具体分型见表11-7和表11-8。WHO急性白血病分型体现在更合理、全面,更适合现代对急性白血病的治疗策略,但对每位白血病患者都进行免疫学、细胞遗传学和分子生物学检查,目前仍有一定难度,因此现在暂未普及应用。
表11-6 急性髓系细胞白血病MIC分型和分子标志
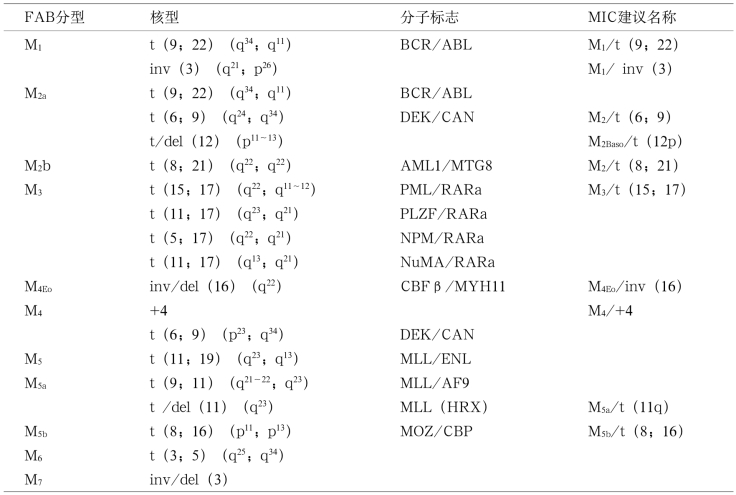
链接 WHO分型在计数原始细胞百分比时,要求血涂片分类200只白细胞,骨髓涂片分类500只有核细胞;除急性红白血病外,都是指骨髓中所有有核细胞中原始细胞的百分比。原始细胞包括原粒细胞、原始和幼稚单核细胞、原巨核细胞,在急性早幼粒细胞白血病时原始细胞则指异常早幼粒细胞。另外,关于AML分型中AML伴骨髓增生异常改变,这型以老年人多见,常继发于患有6个月以上MDS/MPD患者,髓细胞系中至少两系≥50%细胞有病态造血(病态造血见第13章),如果开始就是AML(即非特殊类型AML),一般不出现多系细胞病态造血。非特殊类型AML中各亚型与FAB分型几乎相同。
表11-7 WHO关于急性髓性细胞白血病和相关髓系肿瘤分型(2008)

表11-8 WHO关于急性淋巴细胞白血病分型(2008)








