
3.1.2 元素周期律、周期表及其微观基础
1.元素周期律和周期表
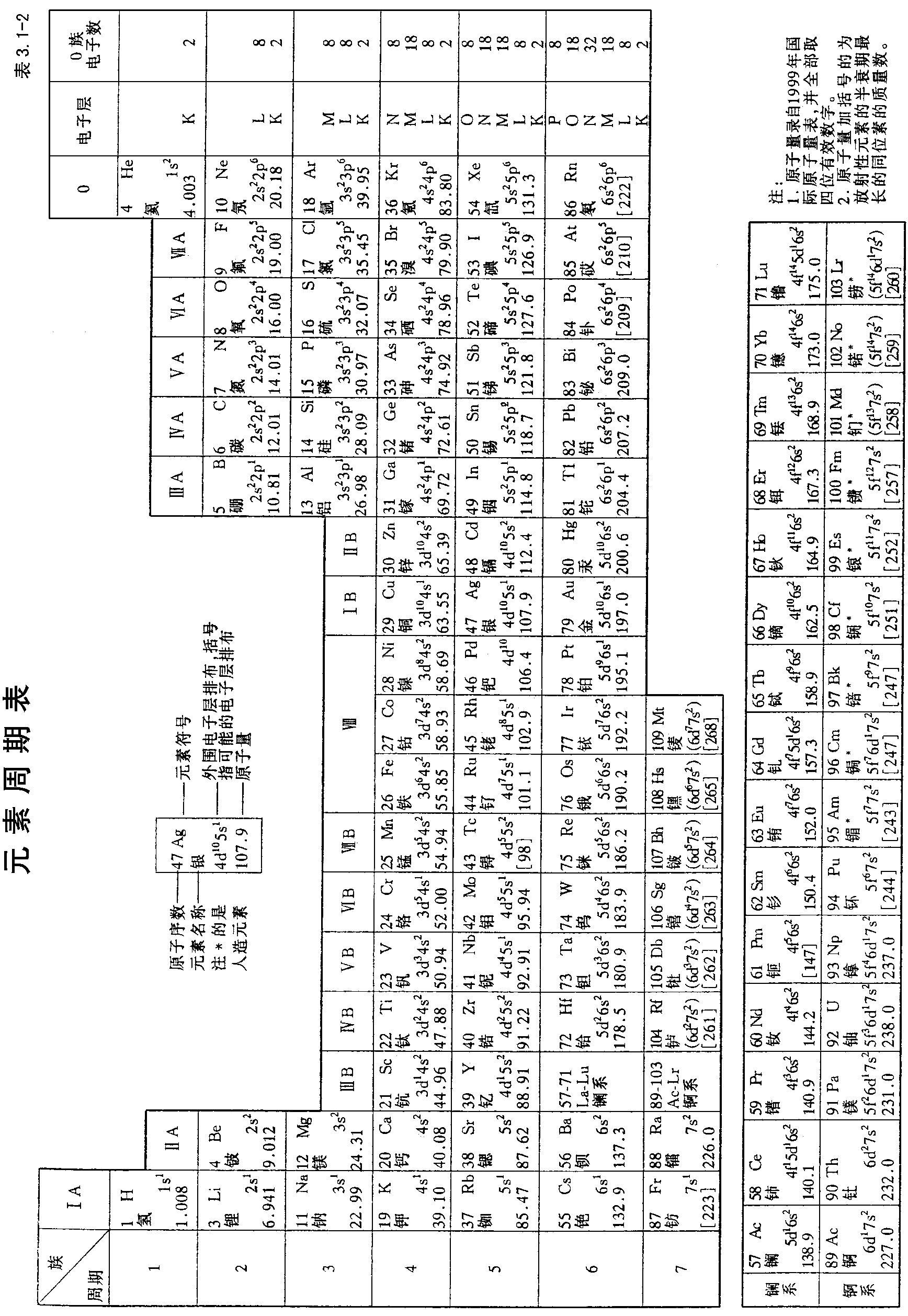
根据大量实验结果,发现元素的性质随元素的原子序数的增加呈周期性变化。这个规律称为元素周期律。根据元素周期律将所有的元素排成一个表,这叫元素周期表,常见的周期表如表3.1-2所示。
周期表中每一横排元素为一个周期。总共有7个周期,第1周期只有2个元素,是特短周期。第2周期、第3周期各有8个元素为短周期。第4、5周期为长周期各有18个元素。第6周期为特长周期有32个元素。第7周期也应有32个元素,但到现在只发现了23个元素,是个未完全周期。
周期表第6周期中从第三个元素57号La(镧)到第71号Lu(镥)和第7周期的第三个元素89号Ac(锕)到第103号Lr(铹),各有15个元素。它们与前面的元素相比,新增加的电子都是填加在(n-2)f轨道上,即分别排在4f和5f原子轨道上,致使它们的性质十分相似,分别称为镧系元素和锕系元素。为了避免周期表横排过长,通常把它们列在周期表下方二个横排中。
周期表中的纵行称为族。族分为两类:一类为主族,另一类为副族。主族元素的电子排布特点是:最后填入的价电子是填入原子的最外层原子轨道ns,np。周期表左面的二个族和右边的六个族为主族。它们分别是IA、IIA和IIIA、IVA、VA、VIA、VIIA和0族(有的称为VIIIA)。周期表中间部分,从左到右共有10行分别属8个副族,它们是IIIB、IVB、VB、VIB、VIIB、VIII和IB、IIB。VIII族占有3个纵行。副族元素的电子按能级顺序最后填入次外层(n-1)d原子轨道中,称为过渡元素。在IIIB副族中还有镧系和锕系元素。镧系和锕系元素称为内过渡元素。
2.原子结构与元素周期表
元素原子结构的周期性变化是元素性质周期性变化的微观基础,也是元素周期表的微观基础,两者间存在密切的内在联系。
1)元素周期与微观结构的关系
①周期总数等于能级组总数。每个周期的序数,即周期数等于相应能级组中各原子轨道的最大主量子数。
②每个周期包含的元素数目,等于相应能级组的原子轨道中可容纳的最多电子数,亦即在同一电子层可能出现的状态总数。参阅表3.1-1和表3.1-2。
2)元素在周期表中的位置与原子结构的关系
(1)元素在周期表中的周期数与原子核外电子的最高电子层数相等
元素在周期表中的周期数等于该元素原子的核外电子所处的最高电子层数,即其相应的最大主量子数n。例如,某元素的原子结构为1s2、2s2、2p6、3s2、3p6、3d5、4s2,则该元素必位于第4周期。
(2)元素在周期表中的族数与原子的价层电子排布特点有关
①主族(零族除外)元素的族数等于相应元素的原子中最外层电子ns与np电子数的总和。如Si的原子结构为1s2、2s2、2p6、3s2、3p2,应为IVA族元素。
②ⅢB-ⅦB族元素的族数等于其原子价电子总数,包括最外层ns电子数和次外层(n-1)d电子数之和。如Cr的原子结构为1s2、2s2、2p6、3s2、3p6、3d5、4s1,应处于ⅥB族。
③ⅠB、ⅡB族元素的族数等于其最外层ns轨道中的电子数。如Cu的价层电子式为3d10、4s1,属ⅠB族。
④Ⅷ(或称ⅧB)族元素包括第8、9、10三个纵行的9个元素,其原子最外层ns电子数和次外层(n-1)d电子数之和分别为8、9、10。如Fe的价层电子排布式为3d6、4s2,应属Ⅷ族。
⑤0(或称ⅧA)族元素的最外层电子数为8,为ns2np6满层排布。如Ar的价层电子式为3s23p6,应为0族。
【例3.1-3】有一元素,在周期表位于第4周期,ⅣA族,试写出该元素原子的电子排布式和价层电子式。
解:第4周期第ⅣA族的价层电子分布为4s24p2(4s与4p电子数总和应为4)
因此其核外电子排布式为1s22s22p63s23p63d104s24p2
3)元素在周期表中的分区
根据元素的外层电子分布(外层电子构型)的特点,可将周期表分为5个区即s区、p区、d区、ds区和f区,见图3.1-2所示。
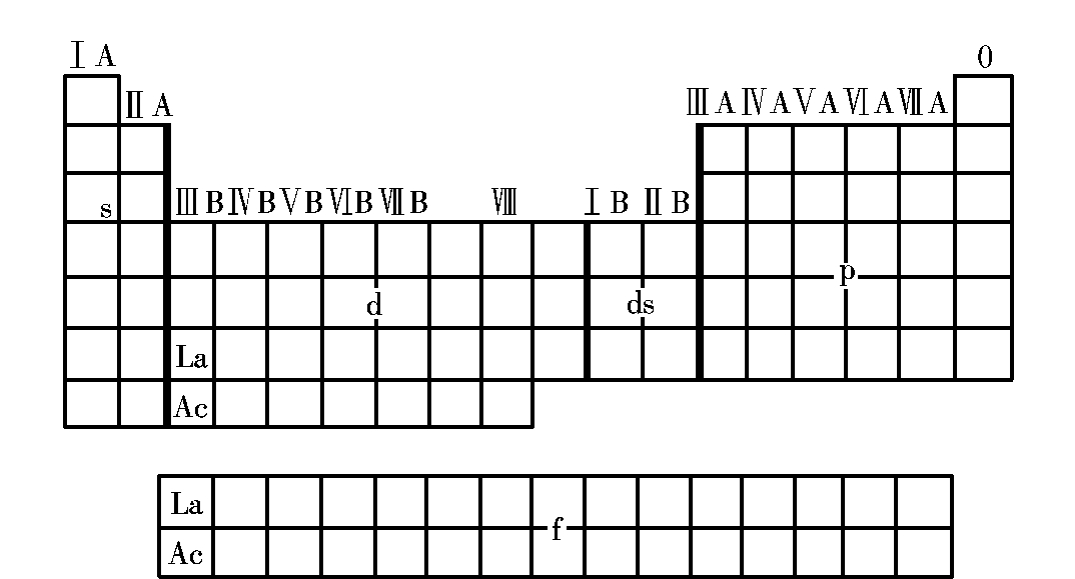
图3.1-2 元素周期表分区图
①s区:包括ⅠA、ⅡA族,外层电子分布为ns1~2。
②p区:包括ⅢA~0族,外层电子分布为ns2np1~6。
③d区:包括ⅢB~Ⅷ族,外层电子分布一般为(n-1)d1~8ns2。
④ds区:包括ⅠB、ⅡB族,外层电子分布为(n-1)d10ns1~2。
⑤f区:包括ⅢB的镧系、锕系元素,其价层电子排布为(n-2)f1~14(n-1)d0~1ns2。
d区、ds区为过渡元素,f区为内过渡元素。
3.元素及其化合物性质的周期性变化
1)金属性和非金属性
元素的金属性与非金属性并没有严格的定义。金属性与非金属性大体可理解为典型的金属与非金属所具有的典型特性。例如金属性可表现为化学反应中原子失去电子的能力,而非金属性可表现为化学反应中原子得到电子的能力。
同一周期自左到右随原子序数(原子核电荷数)增加,金属性减弱,非金属性增强。主族元素变化很明显,副族元素的变化缓慢,并出现一些不规则的情况。
同一族主族元素自上而下随周期数增大(电子层数增多),原子半径一般也逐渐增大,原子核对外层电子的吸引力减弱,元素的金属性增强,非金属性减弱。副族元素除ⅢB外,元素的金属性变化规律不明显,这是因为镧系收缩的缘故。
2)元素的电离能、电子亲合能和电负性
(1)电离能
基态的气态原子失去一个电子形成+1价气态离子时所吸收的能量为元素的第一电离能(用I1表示),第一电离能数值越大,原子越难失去电子。以第二周期为例,总的来说第一电离能(I1)自左至右增大。但是有两处例外即B<Be,O<N,这是因为Be的价电子排布为2s2,是全充满,而N的价电子排布为2s22p3为半充满,比较稳定的缘故。
(2)电子亲合能
基态的气态原子获得一个电子后形成-1价气态离子时所放出的能量称为元素的电子亲合能。
电子亲合能的值越大,原子越容易获得电子。同一周期中自左向右电子亲合能增加,同一族中从上向下,电子亲合能递减,这一规律在p区元素中比较明显。应当指出,元素的第一电离能和元素的电子亲合能的递变规律和元素的金属性、非金属性的变化规律通常是一致的,但并非完全相同。
(3)电负性
它是原子在形成共价分子后,原子吸引共用电子对的能力的相对大小。一般指定F元素的电负性等于4.0,作为比较的标准。其他元素的电负性均小于4,元素周期表右上角的元素有较大的电负性,而周期表中左下角的元素电负性较小。例如Na的电负性为0.9,Cl的电负性为3.0。通常金属元素的电负性小于2,非金属元素的电负性大于2。
3)氧化物及其水合物的酸碱性
根据氧化物与酸、碱反应的不同,可将氧化物分为下列4类。
①酸性氧化物:例如非金属氧化物、高价的金属氧化物。
②碱性氧化物:例如碱金属、碱土金属(铍Be除外)的氧化物。
③两性氧化物:例如Al、Sn、Pb等元素的氧化物,这些大多数是周期表中靠近非金属的一些金属元素的氧化物,其化合价为+2~+4。
④不成盐氧化物:例如CO、NO等,它们不与水、酸、碱作用。
氧化物的水合物都可看成是氢氧化物,用通式B(OH)n或HnBOn表示,n是元素B的化合价。
氧化物的酸碱性与其对应水合物的(氢氧化物)的酸碱性是一致的。
氧化物及其水合物的酸碱性的一般规律如下。
①同一周期从左到右各主族元素的最高价氧化物及其水合物的酸性逐渐增强(碱性减弱)。例如第三周期。各元素最高价氧化物及其水合物的酸碱性递变情况如下:
氧化物Na2OMgOAl2O3SiO2P2O5SO3Cl2O7
水合物NaOHMg(OH)2Al(OH)3H2SiO3H3PO4H2SO4HClO4
酸碱性强碱中强碱两性弱酸中强酸强酸极强酸
长周期副族元素的最高价氧化物及其水合物的酸碱性递变情况基本相似。例如第四周期副族元素的氧化物及水合物的酸碱性递变情况如下:
氧化物Sc2O3TiO2V2O3CrO3Mn2O7
水合物Sc(OH)3Ti(OH)4HVO3H2CrO4HMnO4
酸碱性碱两性弱酸中强酸强酸
②同一族中从上而下各元素相同价态的氧化物及其水合物的酸性逐渐减弱(碱性增强)。如VA族各元素生成的化合价为+5的氧化物中N2O5、P2O5呈酸性,As2O5、Sb2O5呈两性,Bi2O5呈碱性,它们对应的水合物的酸碱性变化规律也是一样的。
③同一元素不同价态的氧化物及其水合物的酸碱性变化规律是:高价氧化物或其水合物的酸性比低价的强。
例如CrOCr2O3CrO3
碱性两性酸性
又如Cl的含氧酸的酸性:HClO<HClO2<HClO3<HClO4
④用R—O—H原则解释氧化物的水合物的酸碱性递变的规律。
氧化物的水合物不论是酸或碱,都具有R—O—H的结构,它有下列两种电离方式

当R是电负性较小的活泼金属元素,Rn+离子的电荷数较少,半径较大,则R与O的联系较弱,易发生碱式电离,在水溶液中易形成OH-离子,呈碱性,如NaOH、Mg(OH)2等。
![]()
当R是电负性较大的活泼非金属元素,Rn+的电荷数较多,半径较小,则R与O联系较强,易发生酸式电离,在水溶液中易生成H+,呈酸性如同H2SO4、HClO4等。
![]()
上一篇:弘扬社会主义核心价值观
下一篇:领导工作状态怎么描述







