
“老君炉”里的“硬汉”
食盐是人的生命不可缺少的必需品,古今中外尽人皆知。俄罗斯就有这样一个风俗,在隆重的迎宾仪式上,送给最尊贵客人的礼物是面包和食盐。
中世纪欧洲的帕拉塞斯(1493—1541)曾在他的“三元素”论中提出:“万物是由水、硫和盐三元素依不同比例构成”,也足见盐在当时人心目中的地位。他认为盐是不挥发、不易燃、能溶于水的“元素”,这种哲学意义上的盐类,实际上是对盐类通性的早期概括。
食盐只是盐类中的一种。盐按其组成可分为含氧酸盐和无氧酸盐两类。它们的性质有多方面,如溶解性、水解性、氧化还原性和热稳定性等。这里我们只介绍含氧酸盐的热稳定性。了解各种含氧酸盐受热分解的产物及稳定性规律,比比看,到底谁受热时不易分解,则谁的热稳定性高,它就是“老君炉”里的“硬汉”。
常见含氧酸盐中较稳定的要属磷酸盐和硅酸盐,加热不易分解,但容易脱水缩合成多酸盐。若将磷酸二氢钠加热到400℃~500℃,可得到三聚磷酸盐。
3NaH2PO4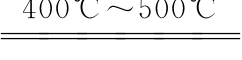 Na3(PO3)3+3H2O
Na3(PO3)3+3H2O
硫酸盐也较稳定,特别是碱金属、碱土金属(Be、Mg、Ca、Sr、Ba)的硫酸盐,如K2SO4、Na2SO4、BaSO4等加热1000℃以上也不分解。但重金属的硫酸盐,如CuSO4、Fe2(SO4)3、PbSO4等,受热则分解成氧化物和SO3;Ag2O则分解为金属Ag。
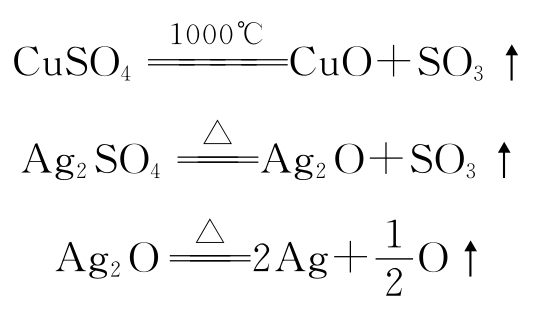
碳酸盐的热稳定性稍逊于硫酸盐,CaCO3、ZnCO3、PbCO3等分解的产物是氧化物和CO2
CaCO3 CaO+CO2↑
CaO+CO2↑
硝酸盐热分解的共同产物是氧气,其他产物决定于硝酸盐中的阳离子:碱金碱和碱土金属的硝酸盐受热生成亚硝酸盐;金属活动顺序在Mg和Cu之间金属的硝酸盐生成氧化物;金属活动顺序在铜以后的金属硝酸盐分解为金属:
2NaNO3 2NaNO2+O2↑
2NaNO2+O2↑
2Pb(NO3)2 2PbO+4NO2→+O2↑
2PbO+4NO2→+O2↑
2AgNO3 2Ag+2NO2→+O2↑
2Ag+2NO2→+O2↑
含氧酸盐的热稳定性有以下四条规律可循:
(1)一般而论,含氧酸盐的稳定性与含氧酸相关:含氧酸不稳定,它的盐稳定性也差。因此,热稳定性有以下顺序:磷酸盐≈硅酸盐>硫酸盐>碳酸盐>硝酸盐>氯酸盐,有数据为证:
![]()
(2)酸根相同、金属阳离子不同时,热稳定性顺序为:碱金属>碱土金属>过渡金属>铵盐,如:
![]()
(3)酸根相同,金属阳离子是碱金属或碱土金属,热稳定性顺序是:阳离子半径大>阳离子半径小:
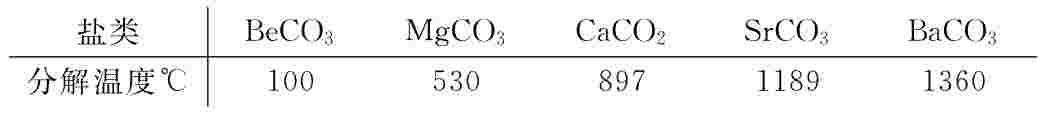
(4)相同金属的正盐和酸式盐相比,热稳定性顺序是:正盐>酸式盐
![]()
含氧酸盐热稳定性的部分规律可以用离子极化理论解释:阳离子极化能力越强,含氧酸盐受热越容易分解,也就是越不稳定。那么什么是离子极化?极化能力的强弱又与哪些因素有关呢?在离子型化合物中,当带相反电荷的阴、阳离子相互接近时,由于相反电场的影响,离子的电子云发生变形。某种离子的“极化作用”就是指这种离子使异号离子电子云发生变形的作用。阳离子可以使阴离子被极化而变形,阴离子也可以去极化阳离子,这是一种相互的作用。阳离子极化能力的大小取决于它所带的正电荷数、阳离子半径和外层电子构型等因素:阳离子的正电荷越高,离子半径越小,其极化能力越强。在高温之下,晶格中的粒子的热振动加强,阳离子使酸根变形,以致能将酸根中的氧夺过来,从而使盐分解。
在碱金属和碱土金属含氧酸盐系列中,阳离子半径自上而下增大,阳离子的极化能力减弱,因而热稳定性增加。如果将碱金属和碱土金属相比较,碱土金属含氧酸盐的热稳定性比同周期的碱金属含氧酸盐要差,因为碱土金属阳离子的正电荷较高,阳离子半径较小,极化能力较强。以上的比较有一个共同的前提,就是这些金属阳离子的外层电子都是8电子构型。
如果将CaCO3和ZnCO3相比,Ca2+、Zn2+阳离子正电荷相同,Ca2+离子半径是99皮米,Zn2+是74皮米,故Zn2+的极化能力强。但这里还有一个影响极化力强弱的重要因素,即离子的电子构型。Ca2+的电子构型是8电子结构,而Zn2+是18电子构型,也是Zn2+极化能力比Ca2+强的原因。因此CaCO3的分解温度是897℃,而ZnCO3只有350℃。所以,影响阳离子极化能力的因素除了正电荷数与离子半径外,还有外层电子构型。电子构型对于极化力的影响有以下顺序:
8电子构型<不规则(9~17e)构型<18和18+2电子构型。在周期表中ⅠA和ⅡA该阳离子的外壳层都是8电子构型;ⅢB→Ⅷ族的阳离子是不规则的9~17电子构型;ⅠB和ⅡB族阳离子(Cu+、Ag+、Au+、Zn2+、Cd2+、Hg2+)是18电子构型;ⅢA→VA族的低价阳离子是18+2电子构型,如,TI+1、Pb2+、Bi 3+等。
阳离子的极化能力不仅影响到其分解温度,还影响其分解产物:阳离子极化能力越强,含氧酸盐分解的产物越简单,AgNO3、Ag2SO4热分解的最终产物是Ag,就是因为Ag+半径小,外壳层又是18电子构型极化能力强的缘故。
掌握了含氧酸盐热稳定性的变化规律,又有极化理论做依据,你能判断下列各组中谁是“老君炉”里的“硬汉”吗?希望你能正确地作出判断。
SrCO3和PbCO3
Na2SO4和Al(SO4)3
KNO3和CsNO3
FeSO4和Fe2(SO4)3
上一篇:我国最大的滑雪胜地
下一篇:声波在耳内传播的阻抗差异







