
能量是永恒的,不会被制造出来,也不会被消灭。但不同能量之间可以相互转化,如热能可以转化成动能,而动能还能够再转化成热能。热力学第一定律是涉及热现象的宏观过程中能量守恒和转换定律的一种表述。表征热力学系统能量的是内能。通过做功A和传热Q,系统与外界交换能量,使系统的内能发生变化ΔE,而总能量是守恒的,因此有ΔE=Q+A。
一、建立背景
18世纪末19世纪初,随着蒸汽机的出现和广泛应用,人们越来越关注热和功的转化问题,甚至有不少人沉迷于研究第一类永动机,他们希望发明一种只需要给一个初始动力以后就能源源不断做功的机械。尽管有不少人进行了尝试却没有人能成功,使人们不得不怀疑永动机是否存在。
1840年,德国物理学家、医生迈尔作为船医远航到印度尼西亚。他从船员静脉血的颜色的不同,发现体力和体热来源于食物中所含的化学能,提出如果动物体能的输入同支出是平衡的,所有这些形式的能在量上就必定守恒。他由此受到启发,开始探索热和机械功的关系。1842年他发表了《论无机性质的力》的论文,表述了物理、化学过程中各种力(能)的转化和守恒的思想。迈尔是历史上第一个提出能量守恒定律并计算出热功当量的人。之后英国杰出的物理学家焦耳、德国物理学家亥姆霍兹等人又各自独立地发现了能量守恒定律。1843年8月21日焦耳在英国科学协会数理组会议上宣读了《论磁电的热效应及热的机械值》论文,强调了自然界的能是等量转换、不会消灭的,哪里消耗了机械能或电磁能,总在某些地方能得到相当的热。焦耳用了近40年的时间,不懈地钻研和测定了热功当量。他先后用不同的方法做了400多次实验,得出结论:热功当量是一个普适常量,与做功方式无关。他自己1878年与1849年的测验结果相同,后来公认值是427kgf·m/kcal。1847年,亥姆霍兹发表《论力的守恒》,第一次系统地阐述了能量守恒原理,从理论上把力学中的能量守恒原理推广到热、光、电、磁、化学反应等过程,揭示其运动形式之间的统一性,它们不仅可以相互转化,而且在量上还有一种确定的关系。能量守恒与转化使物理学达到空前的综合与统一。而热力学第一定律是能量守恒定律在热力学上的一个表现,能量既不能产生也不能毁灭,只会从一种形式变为另一种形式,因此想创造永动机是不可能的,只能尽可能想办法提高热机的效率。
二、热力学第一定律的数学描述和物理解析
热力学第一定律:系统由初态Ⅰ经过任意过程到达终态Ⅱ后,内能的增量等于在此过程中外界对系统传递的热量Q和外界对系统做的功A之和,即
ΔE=Q+A(27-1)
其微分形式为
d E=δQ+δA(27-2)
式中,Q和A是与过程相关的物理量,所以用前标δ表示其微元。由于一个热力学系统的状态由三个宏观参量(p,V,T)唯一确定,通常说一个热力学系统发生了变化,则表征热力学系统状态的三个参量发生了改变,即(p1,V1,T1)→(p2,V2,T2)。如果让这个过程无限缓慢地进行,使过程中的每个状态都可近似地视为平衡态,这个过程中外力所做的功可以表示为
δA=-pd V(27-3)
式(27-3)中的“负”号是我们定义体积缩小时,外力对系统做正功。如果系统膨胀,体积增加,则外界对系统做负功,或者说系统对外界做正功。
三、热力学第一定律的应用
从热力学第一定律的数学表达式可以看出,应用热力学定律首先要解决的就是计算式(27-3)表示的外界对系统做的功。而要积分出式(27-3),知道过程进行中压强p与体积V之间的关系又是解决问题关键的一环。我们下面就几个具体过程来讨论这些问题。
1.等温过程
若系统与外界之间传热良好,而外界又有热容量极大的特点,这样,在它与系统交换热量时,其内部就只经历等温的可逆变化——称为“恒温热源”(如大量的冰水混合物、沸水、某温度下的恒温水浴等),同时对系统的压缩或系统的膨胀又进行得十分缓慢,则这系统所经历的过程可认为是可逆的等温过程。
该过程的方程为
p V=C(27-4)
由于过程中无温度变化,故亦无内能变化,即ΔT=0,ΔE=0。代入热力学第一定律方程有
A=-Q(27-5)
即等温压缩时,外界所做正功完全转化为系统对热源放出的热量;等温膨胀时,从热源吸收的热量全部转化为系统对外做的功。
利用理想气体状态方程易得
2.等容过程
等容过程的过程方程为
V=C(27-7)
式中,C是常数的意思,即该过程体积不变,因此做功为零,即δA=0。系统吸收的热量等于系统内能的增量,即
δQ=d E(27-8)
CV称为系统的定体热容。根据能量均分定理,对于理想气体
式中,ν是气体摩尔数,i是气体分子自由度,R是普适气体恒量,这样
如果考虑每单位摩尔气体的热容量,称为气体的摩尔定体热容,即
这样,系统吸收的热量可以表述如下:
δQ=d E=CVd T=νCV,md T(27-13)
如果系统经历一个定容过程,系统吸收的热量和内能增量为
如果系统的摩尔数和定容摩尔热容为常数,可以积分式(27-14)得
Q=E2-E1=νCV,m(T2-T1)(27-15)
3.等压过程
等压过程的方程为
p=C(27-16)
如果该过程中系统的体积从V1变到V2,则外界所做体积功为
其中“-”表示系统体积增加时外界对系统做负功,系统体积减小时,外界对系统做正功。联系状态方程p V=νRT,又可将式(27-17)改写为
A=-νR(T2-T1)(27-18)
因为内能是状态量,我们仍然可以把内能的变化表示为
E2-E1=νCV,m(T2-T1)(27-19)
根据热力学第一定律,该过程系统吸收的热量为
Q=ΔE-A=ν(R+CV,m)(T2-T1)=νCp,m(T2-T1) (27-20)
式中,Cp,m=R+CV,m叫系统的定压摩尔热容,此等式又称为迈耶公式。
4.绝热过程
若系统在状态变化的整个过程中不与外界交换热量,就是绝热过程。绝对的绝热过程是不存在的,但一些与外界交换的热量只占内能很小比例的过程,可以近似当作绝热过程。以下两种情况就是这样。
(1)过程中系统与外界交换的热量很少。这可能由于系统被良好的隔热材料包围着;或系统边界处导热性能差,过程进行得又很快,系统来不及与外界有显著的热交换,像蒸汽机膨胀中水蒸气的状态变化,还有汽油机压缩冲程(仅需0.02秒)中燃气的状态变化就是这样。
(2)系统本身内能极大。这时过程进行的时间可以很长。例如深海中的洋流,循环一次常需要数十年,洋流与外界交换的热量与其本身巨大的内能相比微不足道。
如此看来,绝热过程进行得可快可慢,也就有准静态与非准静态之分。我们需要有判断过程进行快慢的标准。通常认为过程进行的速度不大于声速就算是较慢的过程,这是因为气体由不均匀趋向均匀的速度在数量级上约等于声速,过程进行速度小于声速时,系统内部便可比较及时地得到调整而近乎均匀。理想气体绝热自由膨胀、爆炸等过程就是典型的非准态静态绝热过程。
对任何绝热过程,均视其交换的热量δQ=0,根据热力学第一定律有
A=ΔE=νCV,m(T1-T2)(27-21)
在处理绝热过程时,习惯采用比热容比γ=Cp,m/CV,m,又称为绝热指数。对理想气体,已知有迈耶公式
Cp,m=CV,m+R
易导出
因此,A=ΔE=ν (T2-T1)=
(T2-T1)=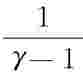 (p2V2-p1V1)(27-22)
(p2V2-p1V1)(27-22)
为了弄清楚绝热过程进行中系统三个状态参量p,V和T之间的变化关系,我们需要一个绝热过程方程。因为只有准静态可逆绝热过程p,V和T之间才有稳定的分析表达式,所以,下面推导准静态可逆绝热过程方程。
我们知道准静态可逆绝热过程的特征δQ=0,δA=d E,因此有
νCV,md T=-pd V(27-23)
再对理想气体状态方程两边微分得
pd V+Vdp=νRd T(27-24)
联立式(27-23)与式(27-24),消去变量T,有
转化整理得
当γ为常数时,可得到:
p Vγ=C(27-26)
式(27-26)就是理想气体准静态可逆绝热过程的方程。这样,若已知初始状态的压强p1、体积V1,可以给出可逆绝热过程中任何中间态的压强,即p=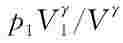 ,并且可由此计算可逆绝热过程的功为
,并且可由此计算可逆绝热过程的功为
5.多方过程
一个热力学过程可能既不等容又不等压,既不等温又不绝热,但热容量是常数,我们也可以找出其过程方程。
设在此热力学过程中理想气体的摩尔热容为Cn,m。按热力学第一定律及理想气体状态方程,有
νCV,md T=νCn,md T-pd V(27-28)
和
pd V+Vdp=νRd T(27-29)
联立式(27-28)和式(27-29),消去变量T,可得
若令
式(27-30)即可化成
对于给定种类的理想气体,在不太大的温度范围内,其定体(或定压)摩尔热容为常量,n亦为常数,积分式(27-31)有
p Vn=C1(27-32)
式(27-32)即是多方过程方程,其中n叫多方指数。多方过程中外界对系统做的功为
由于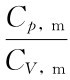 =γ,多方过程的摩尔热容可表为
=γ,多方过程的摩尔热容可表为
另外,我们发现等压、等温、绝热、等容过程分别是n=0,n=1,n=γ,n=±∞的特殊多方过程。
四、应用举例
例 某气缸内装有氦气和氢气的混合气体共5.2g,今测得混合气体的定体摩尔热容为2.2R。求:
(1)气缸内装的混合气体中氦气和氢气的质量各为多少?
(2)若让混合气体做等压膨胀,系统对外做功为500J,该过程中系统吸收的热量为多少?
解:(1)设氦气有ν1mol,氢气有ν2mol,氦气摩尔质量为4g,氢气的摩尔质量为2g,根据题意有
4ν1+2ν2=5.2 ①
根据能量均分定理,可知氦气和氢气的定体热容CV,m分别为 R与
R与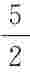 R,而根据混合气体摩尔定体热容的定义有
R,而根据混合气体摩尔定体热容的定义有
式①、式②联立解之得
ν1=0.6mol
ν2=1.4mol ③
进而氦气和氢气的质量分别为
m1=ν1MHe=0.6×4=2.4g
m2=ν2MH2=1.4×2=2.8g ④
(2)根据题意有
系统气体的内能可表示为
根据理想气体状态方程有
p V=νRT⇒p(V2-V1)=νR(T2-T1) ⑦
将式⑤代入式⑦,式⑦再代入式⑥可得
ΔE=2.2p(V2-V1)=1100J ⑧
根据热力学第一定律ΔE=A+Q,得
Q=ΔE-A=1600J ⑨
五、课后习题
27-1 如图27-1所示,某双原子分子理想气体由初始状态:p1=4×103Pa,V1=1L,分别经(a)等压过程、(b)等温过程、(c)绝热过程膨胀到V2=4L,试比较三个过程中外界对系统做的功、系统内能的改变以及系统吸收的热量。
图27-1
27-2 一水平放置的气缸内有一不导热的活塞,活塞将气缸分为A、B两部分,两部分的体积都为0.5L,都装有p0=105Pa,T0=273K的双原子理想气体。现在将A部分缓慢加热,直到A内的压强增加到3×105Pa为止。假设气缸除加热壁之外其余部分都绝热,且活塞与气缸之间的摩擦可忽略不计,求在此过程中传入A中的热量。
27-3 单原子理想气体从状态Ⅰ(p1,V1,T1)出发经过一直线过程到达状态Ⅱ(p2,V2,T2),求这个过程中外界对系统做的功和系统吸收的热量。
上一篇:拉扎勒斯的简介
下一篇:古典学派的国际贸易理论







