
7.3 溶液表面的吸附现象
溶液和纯液体不同,它含有溶剂和溶质两种不同的分子。如果在表面层中溶质分子比溶剂分子所受到的指向溶液内部的引力还要大些,则这种溶质分子的溶入将使溶液的表面张力增高,从能量趋于最低的原则出发,这种溶质倾向于较多地进入溶液内部而较少地留在表面层中,以求使溶液的表面张力尽量低些,从而降低体系表面能。这样就造成了溶质在表面层中比在本体溶液中浓度小的现象,如果在表面层中溶质分子比溶剂分子所受到的指向溶液内部的引力要小一些,那么,这种溶质的溶入将使溶液的表面张力减小。而且,溶质分子将倾向于在表面层相对地浓集以求更多地降低溶液的表面张力,从而更多地降低溶液的表面能,因此造成了溶质在表面层中比在本体溶液中浓度大的现象。我们把溶质在表面层中与在本体溶液中浓度不同的现象叫做“溶液的表面吸附”。若溶质在表面层的浓度高于本体浓度,称为“正吸附”,反之则称为“负吸附”。
Gibbs(吉布斯)于1878年用热力学方法导出了反映溶液表面吸附量Γ与溶液表面张力随浓度变化率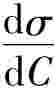 之间关系的公式,即著名的Gibbs吸附等温式:
之间关系的公式,即著名的Gibbs吸附等温式:
![]()
其中Γ是溶质在表面层的吸附量(单位面积的表面层所含溶质的摩尔数比同量溶剂在本体溶液中所含溶质摩尔数的超出值),称为溶质的吸附量或表面过剩量(mol·m-2);C为溶质在溶液本体中的平衡浓度(mol·l-1),σ为溶液的表面张力(J·m-2),T为绝对温度,R为气体常数。
由Gibbs吸附等温式可知:当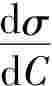 <0,即增加浓度使表面张力下降时,Γ>0,即溶质在表面层发生正吸附;当
<0,即增加浓度使表面张力下降时,Γ>0,即溶质在表面层发生正吸附;当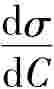 >0,即增加浓度使表面张力升高时,Γ<0,即溶质在表面上发生负吸附;当
>0,即增加浓度使表面张力升高时,Γ<0,即溶质在表面上发生负吸附;当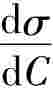 =0,Γ=0,则说明此时无吸附作用,这一结论与实验结果是完全一致的。
=0,Γ=0,则说明此时无吸附作用,这一结论与实验结果是完全一致的。
若用Gibbs吸附等温式计算某溶质的吸附量,必须预先知道dσdC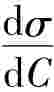 的大小,为求得
的大小,为求得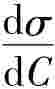 dσdC值,可先测定不同浓度C时的表面张力σ。以σ对C作图,求得曲线上各指定浓度时的斜率,即为在实验温度该指定浓度C时dσdC
dσdC值,可先测定不同浓度C时的表面张力σ。以σ对C作图,求得曲线上各指定浓度时的斜率,即为在实验温度该指定浓度C时dσdC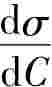 的值,就可计算出相应的吸附量Γ。
的值,就可计算出相应的吸附量Γ。
例:21.5℃时,测得β-苯基丙酸(分子量M=150.1)水溶液的表面张力(牛顿×米-1)和浓度C(克×千克水-1)的数据如下:
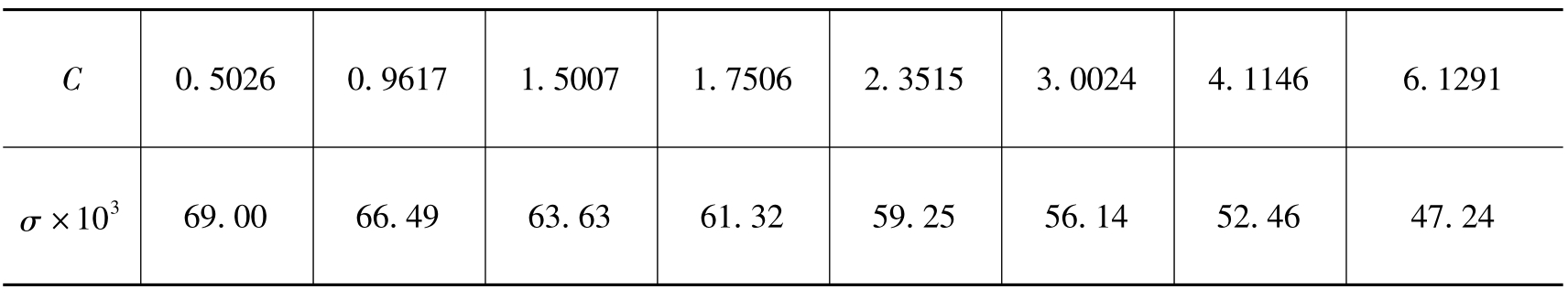
试求当溶液浓度为1.5g/kg水时溶质的表面吸附量Γ。
解:据题所给数据作σ-C图,并作C为1.5g/kg水曲线处的斜率:
![]()
![]()
上一篇:为何需要电子商务运营管理
下一篇:细菌毒素和外毒素的区别







