
一、整合蛋白分子结构与性质
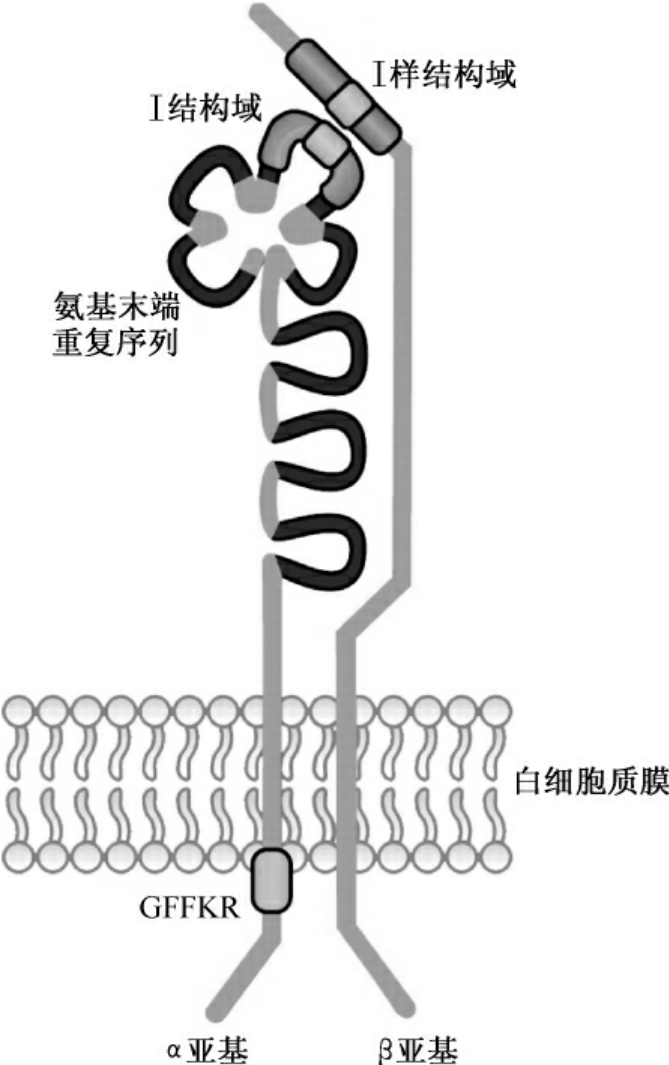
图3-1 整合蛋白α和β亚基示意图(所示为β2整合蛋白)
整合蛋白由α和β亚基组成异二聚体,其α亚基有16种,分子量为(1.2~1.8)×105,β亚基至少也已发现8种,分子量为(0.9~1.0)×105。从理论上推算,8个β亚基和16个α亚基可以组成100种以上的二聚体,而真正存在的异二聚体种类是相当有限的,这是因为有些α亚基仅与单一种类的β亚基组合,其分子机制十分复杂。例如,血细胞不仅表达β2,也表达β1亚基,但仅出现β2与αL、αM和αX亚基形成的异二聚体,而没有β1与αL、αM和αX亚基形成的异二聚体。此外,一种整合蛋白可在多种类型细胞表面出现,而一种细胞也可共存多种整合蛋白。整合蛋白这一分布特点,说明细胞与基质、细胞与细胞的黏附现象是由多分子参与的综合效应。
整合蛋白各α和β亚基均由独立的基因编码,而并非mRNA不同剪切所致。编码各种亚基基因的染色体定位相当分散,即使能够形成异二聚体的亚基基因也分布在2个不同的染色体上,如α5β1、α6β1等,只有血小板中异二聚体αⅡbβ3的αⅡb和β3基因都存在于染色体17q21.3位置。有关整合蛋白α、β基因在不同细胞中的表达调控和亚基间相互诱导作用的研究已受到关注。
α和β亚基属于Ⅰ型跨膜糖蛋白,含有疏水的一次跨膜肽段(图3-1)。除β4亚基外,各α和β亚基C端的胞内肽段很短,小于50个氨基酸。α和β亚基的N端胞外肽段较大并相互以非共价键结合形成二聚体。体外实验发现,缺失跨膜肽段和胞内肽段的α和β亚基仍可相互结合形成二聚体,并且发挥与配体黏附的功能。α、β两种亚基均含丰富的二硫键,致使亚基折叠较为紧密,有利于抵抗细胞蛋白酶的水解。有些α亚基,如α5亚基,含有一个链间二硫键,因此在还原条件下可以产生一大、一小两个片段。β亚基近跨膜处有4个重复的折叠结构,含链内二硫键。所有β亚基近N端均含有一段由7个重复折叠同源序列组成的肽段,其中最外的3或4个同源序列含有AspXAspXAspGlyXXAsp(X为任意一种氨基酸),为结合二价阳离子所必需。阳离子结合可以影响配体的亲和力和专一性,因此,应用配体亲和层析分离和纯化整合蛋白时,必须有一定浓度的阳离子存在。
体内大部分组织可以表达α1β1、α2β1、α3β1和α6β1整合蛋白,主要与胶原(collagen)和层粘连蛋白(laminin,Ln)结合。而与纤粘连蛋白(fibronectin,Fn)结合的α5β1整合蛋白,在大部分组织中表达较少,大血管内皮细胞属例外。αV亚基在表皮细胞高度表达,主要与β5和β6组合成二聚体,而不是β3亚基。通常认为白细胞主要含有β2亚基,但也有α4β1,α4β7,α5β1和α6β1;而血小板的整合蛋白仅为αⅡbβ3类型。由此可见不同整合蛋白具有不同的组织分布的特异性。
上一篇:如何寻找对象感
下一篇:文化与经济发展的关系







