
任务1 金属的晶体结构
一、金属的特性
目前已知自然界存在的107种元素中,金属元素占80%以上。金属的优异性能和丰富储藏量使其在国民经济各领域中被广泛使用。金属具有良好的导电性、导热性,其导电性比非金属元素大1020~1025倍,某些金属在绝对零度会表现出“超导电性”,即电阻突然下降,数值趋于零,具有良好的反射光线能力、塑性变形能力,以及良好的工艺性能和不透明性。
金属的特性是由金属原子的内部结构及原子间的结合方式所决定的。周期表左边Ⅰ、Ⅱ、Ⅳ主族元素均在满壳层外有一个或几个价电子,由于满壳层的屏蔽作用,原子核对外层轨道上的价电子吸引力不大,很容易摆脱原子核的束缚变成自由电子。当大量金属原子聚集在一起构成金属晶体时,大部分或全部的原子都会丢失价电子转变成正离子,这些被丢失的价电子为全部原子所公有,这些公有的电子称为自由电子,它们在正离子间自由运动,形成所谓的“电子气”。金属晶体就是依靠正离子和电子气之间产生的强烈静电吸引力结合起来的,这种结合力就是金属键。
金属键中存在的大量自由电子在外加电压作用下做定向移动,表现出优良的导电性。随着温度的升高,正离子在平衡位置上的振动增强,金属中的空穴增多,原子的规整排列受到干扰,电子运动阻力增大,所以金属有正的电子温度系数。自由电子的活动性及其离子的振动使金属具有良好的导热性。金属中的自由电子能吸收并随后辐射出大部分投射到金属表面上的光能,因而金属具有不透明性,并能够反射出金属特有的光泽。金属键没有方向性,对原子无选择性,受外力发生形变后,金属中的正离子与自由电子间仍能保持以金属键的结合,表现出良好的塑性。
二、晶体结构的基本概念
1.晶体与非晶体
固态物质按其原子(或分子)的聚集状态可分为晶体和非晶体两大类。在晶体中原子(或分子)按一定的几何规律呈周期排列的方式称为晶体结构。简单立方晶体结构示意图如图2-1(a)所示,非晶体中原子是无规则地堆积在一起的。
在自然界中,除少数物质(如普通玻璃、沥青、石蜡等)是非晶体外,绝大多数固态无机物都是晶体。晶体有固定的熔点,且具有各向异性,一般情况下固态金属都是晶体。而固态非晶体没有固定的熔点,它随着温度的升高逐渐变软,最终成为有显著流动性的液体,液体冷却后逐渐稠化,最终变成固体。此外,因非晶体物质在各个方向上的原子聚集密度大致相同,因此表现出各向同性的性质。
晶体和非晶体在一定条件下可以互相转化。例如,玻璃经高温长时间加热能变为晶态玻璃;而通常是晶态的金属,如从液态急冷也可获得非晶态金属。
2.晶格、晶胞和晶格常数
1)晶格
为描述晶体内部原子排列的规律,把原子抽象为空间几何点,并用假想空间直线把这些点连接起来构成的三维几何格架称为晶格,图2-1(b)所示的是简单立方晶格示意图。
2)晶胞
从晶格中选取一个能够完整反映晶格特征的最小几何单元,称为晶胞,图2-1(c)所示的是简单立方晶胞示意图。
3)晶格常数
晶胞各棱边尺寸a、b、c称为晶格常数,以(埃)为度量单位(1=10-10 m)。晶胞各棱间夹角分别用α、β、γ来表示,如图2-1(c)所示。
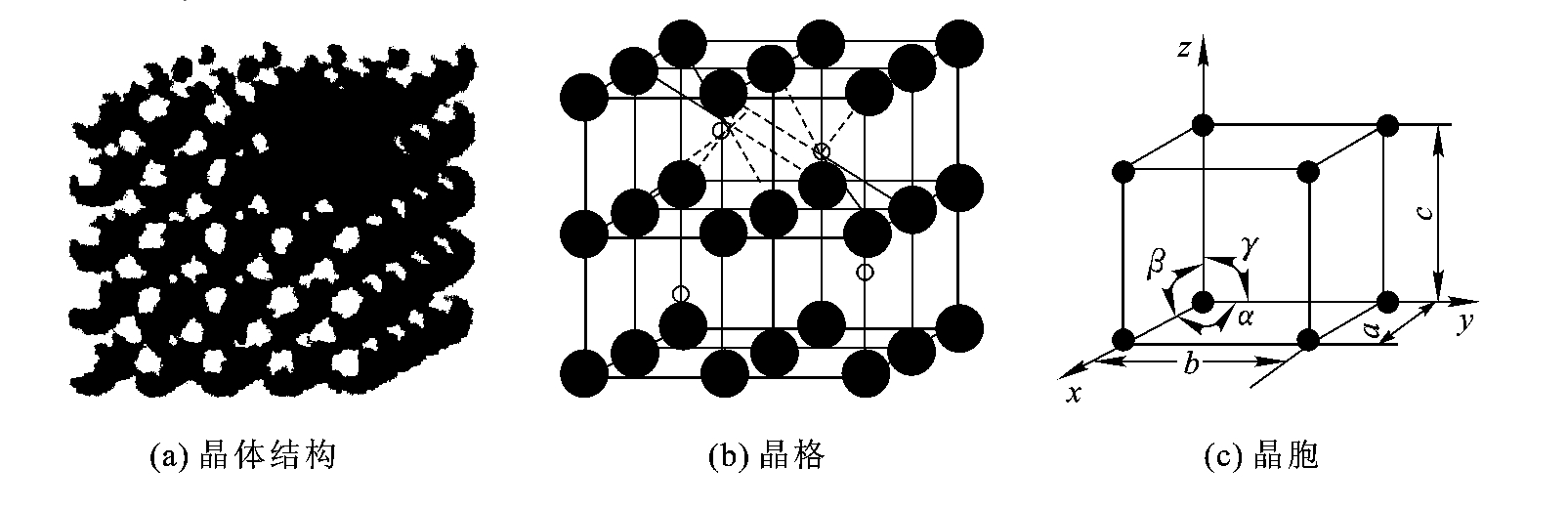
图2-1 简单立方晶体结构示意图
3.原子半径
原子半径是指晶胞中原子密度最大方向上相邻原子之间距离的一半。
4.晶胞原子数
晶胞原子数是指一个晶胞内所含的原子数目。
5.配位数和致密度
配位数和致密度是表示晶格中原子排列紧密程度的参数。配位数是晶格中与任一原子等距离且相距最近的原子数目。晶胞中原子本身所占的体积分数称为致密度。
三、三种常见的晶格类型
利用X射线结构分析技术,证实了大部分金属的晶格类型分为体心立方晶格、面心立方晶格和密排六方晶格三种典型结构。
1.体心立方晶格
体心立方晶格的晶胞如图2-2所示,是边长为晶格常数a的立方体。在立方体的中心和8个顶角上各有1个原子,由于顶角上的原子为相邻的8个晶胞所共有,实际每个体心立方晶格的晶胞占有2个原子,即(1/8)×8+1=2(个)。属于体心立方晶格的常见金属有铁(α-Fe)、钨(W)、钼(Mo)、钒(V)、钛(β-Ti)等。
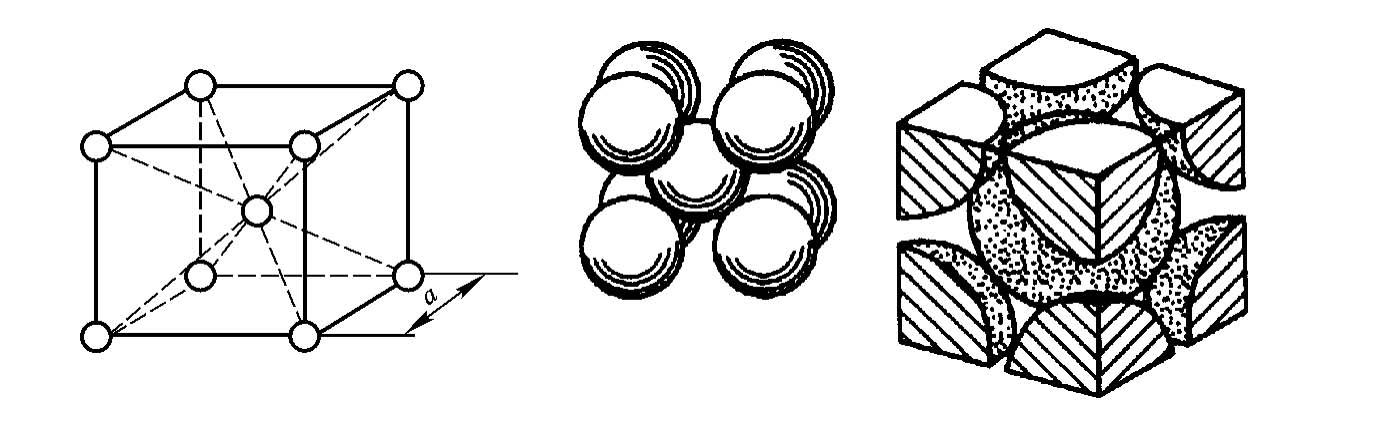
图2-2 体心立方晶格的晶胞
2.面心立方晶格
面心立方晶格的晶胞如图2-3所示,也是一个边长为晶格常数a的立方体。立方体的8个顶角和6个表面的中心都排有1个原子。面心立方晶胞每个角上的原子为相邻的8个晶胞所共有,每个面中心的原子为2个晶胞所共有,面心立方晶胞中的原子数为(1/8)×8+(1/2)×6=4(个)。属于面心立方晶格的常见金属有铁(γ-Fe)、铝(Al)、铜(Cu)、银(Ag)、金(Au)、铅(Pb)、镍(Ni)等。
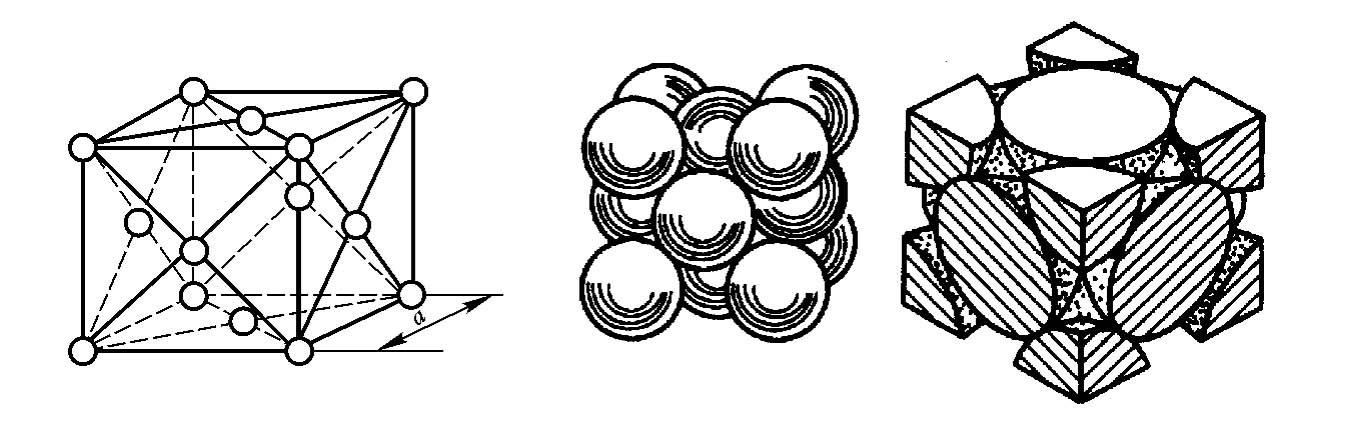
图2-3 面心立方晶格的晶胞
3.密排六方晶格
密排六方晶格的晶胞如图2-4所示,是正六棱柱体。柱体高度c和六边形边长a为两个晶格常数,其比值约为1.633,每个顶角上和上、下底面中心都排列着1个原子,在中截面上均匀分布着3个原子。由图2-4可知,密排六方晶格的晶胞每个角上的原子为相邻的6个晶胞所共有,上、下底面中心的原子为2个晶胞所共有,在晶胞内部的3个原子为该晶胞单独所有,因而密排六方晶格的晶胞中的原子数为1/6×12+1/2×2+3=6(个)。属于密排六方晶格的常见金属有镁(Mg)、锌(Zn)、铍(Be)、钛(α-Ti)、镉(Cd)等。
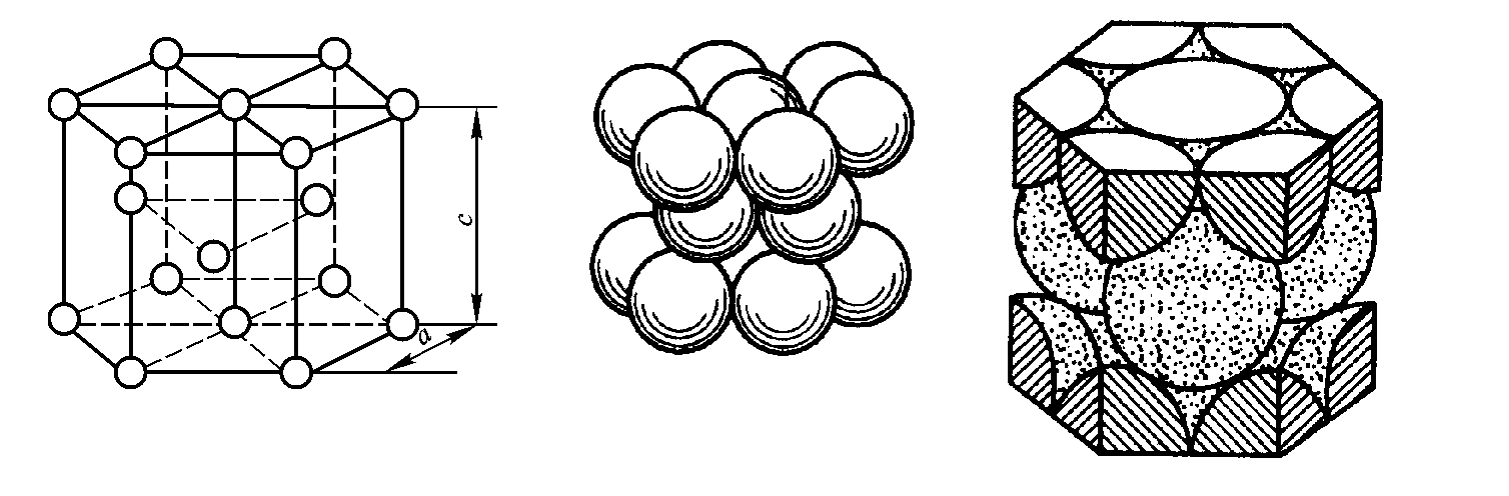
图2-4 密排六方晶格的晶胞
各种金属的晶体结构不同,即晶格类型与晶格常数的不同,往往表现出不同的性能。一旦同种金属的晶体结构发生变化就将引起性能的变化。







