
早在操纵子模型刚刚提出的时候,雅各布和莫诺就假设温和噬菌体的复制是由一个类似乳糖操纵子的系统来调控的。在溶原态时,原噬菌体处于被抑制的状态,在溶裂态时,与噬菌体复制有关的基因均被激活,处于诱导状态。从雅各布和莫诺提出噬菌体的操纵子调控概念到现在,λ噬菌体已经成为在遗传学上了解得最清楚的生物体之一。研究表明λ噬菌体的两种不同的功能态的变换,确实是由类似操纵子这样的遗传调控系统来调节和控制的,但实际情况比原先设想的要复杂得多。
提出噬菌体DNA整合模型的A.坎贝尔曾分离和定位了λ噬菌体的许多条件致死突变,发现一些功能密切相关的基因,在结构上也是成丛排列紧密连锁的。例如编码头部蛋白的10个基因集中在染色体的一端,接着是11个与尾部蛋白合成有关的基因,而与溶裂寄主细胞有关的功能基因则位于染色体的另一端。值得注意的是,差不多与噬菌体的增殖调控以及溶原态的建立密切相关的基因也是连锁在一起的(图4-8)。这个区段的结构和功能是本节讨论的重点。
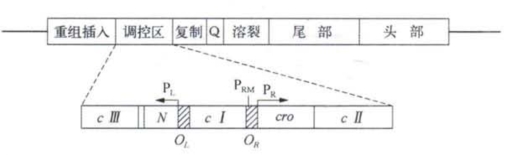
图4-8 λ噬菌体基因组及其调控区段的遗传学图
当λ噬菌体感染野生型大肠杆菌时,可能发生两种后果:①噬菌体DNA整合于寄主细胞染色体而成为原噬菌体,寄主细胞也同时成为溶原菌;②噬菌体利用寄主细胞的酶系合成一系列为复制和成熟所必需的酶和包括结构蛋白在内的其他蛋白质,导致噬菌体的增殖和寄主细胞的溶裂。野生型噬菌体颗粒感染敏感菌平板时会形成噬菌斑,但由于一部分溶原性细菌的存在,野生型噬菌体形成的噬菌斑是混浊的,不完全透明的。如果用不能使寄主细胞溶原化的突变型噬菌体来感染敏感菌平板,则所形成的噬菌斑是清澈透亮的,这种突变称为c突变。一般从清亮的噬菌斑中,可分离到c突变型噬菌体。c突变型噬菌体间的杂交连锁分析和互补分析表明,造成c表型的有三种突变,分别称为cⅠ、cⅡ和cⅢ
cⅠ的条件突变型噬菌体在限制性条件下不能建立溶原态,当它感染已被野生型噬菌体溶原化细菌时却又不能溶裂寄主细胞,即处于溶原态的野生型原噬菌体能抑制cⅠ突变体进入增殖溶裂周期。这暗示cⅠ突变很可能是调控系统中阻遏物的缺陷突变(可设想λ中的cⅠ突变是和乳糖操纵子中LacⅠ突变相当的)。 λ噬菌体还有一种烈性突变(virulent mutation),它不但不能使寄主细胞溶原化,还能在已经溶原化的细菌中复制和增殖。这很可能是调控系统中的操纵基因突变,造成了它对阻遏物的不敏感(可设想这种烈性突变和LacO突变相当)。基因定位研究表明cⅠ基因两侧各有一个操纵基因,分别取名为左操纵基因OL和右操纵基因OR(图4-8)。每个操纵基因各带一个促进子PL和PR,这两个操纵基因的转录分别沿不同方向离cⅠ而去,所以PROR和OLPL转录的DNA信息链是不同的。进一步分析表明每个λ基因组能和6个cⅠ编码的阻遏物分子结合,OL和OR各能结合3个。值得注意的是cⅠ基因的促进子PRM和OR的阻遏物结合区段是部分重叠的。
当噬菌体感染细菌细胞时,细胞内开始并没有λ的阻遏物。这时寄主细胞的转录酶开始转录噬菌体的DNA上的遗传信息。一支由OL开始通过N基因;另一支由OR开始通过cro基因(图4-9)。N基因的产物N蛋白是一个正调控因子,它能通过改变寄主细胞转录酶的构型,使转录酶能通过N基因和cro基因边缘的转录弱化区段,向左进行到整合基因int,向右进行到另一个调控基因P。在int和P之间的基因都和噬菌体DNA的复制、重组和整合有关,如cro(control of repressor andother things)基因的产物cro蛋白能和cⅠ的促进子PRM结合而抑制cⅠ转录和编码阻遏物,也就是说cro蛋白是阻遏物合成的阻遏蛋白,或者可称为抗阻遏物(antirepressor),它对λ噬菌体能否进入溶裂相起着决定的作用。另一方面cⅠ编码的阻遏物也可通过与OR结合而关闭cro基因的转录。实际上cro和c的活性是相互排斥、互不相容的,cro活性是溶裂反应所必需的,cⅠ活性是溶原反应所必需的。在N蛋白的影响下,cⅢ和c Ⅲ均得以表达,它们的产物使RNA聚合酶从另一个cⅠ的促进子PRE(图4-9中未显示)来转录cⅠ基因,PRE对cⅠ转录起始的效率高于PRM。然而,在cⅡ、cⅢ的蛋白产物促进cⅠ表达活性的同时,cro蛋白又试图抑制cⅠ的表达。一旦cro占了上风,它会关闭cⅠ的转录,随之λ基因组的其他基因都会经不同的活化途径而得以表达,从而使λ进入溶裂相。从λ噬菌体的增殖调控机制我们看到了一个操纵子复合体(complexofoperons)的结构和它内部的功能制约关系。

图4-9 λ噬菌体的调控区段的基因转录调控示意
在溶裂途径中,λ噬菌体的基因组是以一个特定的时间序列得以充分表达的。最先表达的是与DNA复制和重组有关的基因,随之表达头部蛋白和尾部蛋白;最后合成的是溶裂寄主细胞的蛋白质。这个表达次序非常重要,如果表达的次序颠倒了,如过早地表达溶裂蛋白基因,是不利于λ发育的,甚至产生致死作用。决定这个表达顺序的是一系列调控蛋白,如N蛋白控制早基因的表达,Q蛋白控制晚基因的表达。
在溶原化周期中,λ噬菌体可处于三种不同的状态:①溶原态的建立;②溶原态的维持;③溶原态的破坏(释放噬菌体)。在建立溶原态的过程中,必须做两件事:①将DNA整合于寄主细胞染色体;②关闭与溶裂反应有关的全部基因。这两个过程的细节尚不清楚。维持溶原态的关键是只表达cⅠ基因,它是编码阻遏蛋白的。阻遏蛋白有两个结合靶位,OL和OR。阻遏OL可阻断早基因群左向转录,致使包括N基因在内的许多基因不能表达。阻遏OR可阻断右侧的cro基因和Q基因的表达。实际上,当阻遏蛋白和OL与OR结合时就关闭了除cⅠ以外的全部基因。当寄主细胞内外环境中的某些因素破坏cⅠ蛋白时,处于原噬菌体状态的DNA会通过逆向整合而脱离寄主细胞染色体,并依次表达溶裂态的相关功能。
美国病毒学家普塔什尼(M.Ptashne)分离纯化了λ噬菌体的阻遏蛋白,这是一个单体分子量为26 000的蛋白质,在单体和功能态的多聚体之间有一个动态平衡。实验证实了OL和OR都是阻遏蛋白结合靶位的假设,并进一步弄清楚OL和 OR各包含三个结合点(图4-10),每个结合点由17个碱基对组成,均为A—T富集区段,间隔为3~7个碱基对。各个结合点的核苷酸序列相近而不尽相同,但都包含一个回文结构。在三个结合点中,和阻遏蛋白结合力最强的是最靠近受控操纵子第一个结构基因的结合点。N基因的促进子序列位于OL区段内,cro基因的促进子位于OR区段内。随着结合于OL和OR的阻遏蛋白数目的增加,对RNA聚合酶的移动和mRNA延伸的阻遏作用也会逐渐增强。
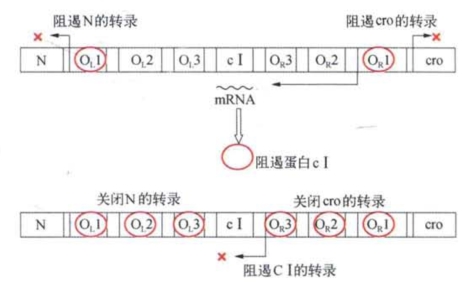
图4-10 λ噬菌体阻遏蛋白cⅠ合成的自我调节示意
必须强调的是在一个溶原化的大肠杆菌中,λ阻遏蛋白的数量是受到精确控制的。如果阻遏蛋白数量过少,即使是一时性过低,也会导致溶裂反应。另一方面,如果阻遏蛋白水平过高,一旦寄主细胞出现不能继续让原噬菌体寄生的状况,λ就会失去及时转入溶裂态的机会。那么,λ阻遏蛋白的水平是怎样被控制的呢?研究表明,λ阻遏蛋白的合成是自我反馈调控的。具体地讲,当阻遏蛋白和OR3结合时,cⅠ基因被关闭(图4-10);相反,当阻遏蛋白只和OR1结合时,则会促进cⅠ的转录。由于阻遏蛋白与OR 1的亲和力比与OR3的亲和力强,因此处于低水平时的阻遏蛋白只和OR 1结合而促进cⅠ转录,而高水平时阻遏蛋白就会通过和OR3结合而抑制cⅠ的表达。
怎样打破溶原化周期呢?关键是使阻遏蛋白的水平降到足以使cro基因得以表达的数量。新合成的cro蛋白也可通过和OR3结合而阻遏cⅠ基因的转录。关键是cro蛋白和OR3的结合能力大于和OR 1的结合力。这样,低水平的cro蛋白能抑制cⅠ的表达,而并不关闭cro基因自身的转录。cro蛋白数量的积累使阻遏蛋白完全不能合成,保证了溶裂反应成为不可逆的一种连续反应。在这个实例中,我们看到了一两种调节蛋白和几个结合靶位之间的精确而巧妙的互相作用是如何决定噬菌体发育方向的。在原核生物中还发现过多个类似的、包含了亲和力不同的蛋白结合位点的调控系统。
前面几节讨论了原核生物中基因表达调控的几种模型,大致可分为调控转录起始和转录终止两类。实际上,在原核生物中还存在着翻译水平的调控和翻译后的调控。这些调控更多地涉及细胞生物化学反应,且多数不在遗传水平上,这里就不深入讨论了。
上一篇:sql字符串转换为数值
下一篇:书姜次生印章前







