
系统在某一无限小过程中吸收热量dQ与温度变化dT的比值称为系统在该过程的热容量,用C表示,即
![]()
热容量表示在该过程中,温度升高1K时系统所吸收的热量,单位是J/K。单位质量的热容量称为比热容c,单位为J/(K·kg),其值由物质和过程决定。热容量与比热容的关系为C=Mc。
1.摩尔定容热容
1mol理想气体在等容过程中吸收的热量dQ与温度的变化dT之比称为摩尔定容热容,即
![]()
上式最后一个等号用到了“理想气体的内能只是温度的函数、与体积无关”的结论。
式中,i是理想气体分子的自由度。
2.摩尔定压热容
1mol理想气体在等压过程中吸收的热量dQ与温度的变化dT之比称为摩尔定压热容,即
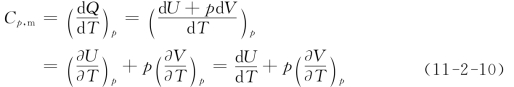
上式最后一个等号用到了“理想气体内能只是温度的函数、与压强无关”的结论。
![]()
上式称为迈耶方程。等压过程与等容过程相比较表明,理想气体的摩尔定压热容比摩尔定容热容大一个恒量R。这是由于等容过程吸收的热量仅用于增加系统的内能,而等压过程中吸收的热量除了用于增加系统内能之外还需用于对外做功。
注意到C,=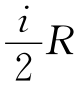 ,式(11-2-11)可改写成
,式(11-2-11)可改写成
Vm
![]()
式中,i是理想气体的自由度。
对于单原子分子,i=3,C,=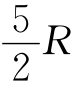 ;对于刚性双原子分子,i=5,C,=
;对于刚性双原子分子,i=5,C,=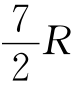 。
。
pmpm
3.比热容比
摩尔定压热容与摩尔定容热容之比称为系统的比热容比,用γ表示,即由上式可以看出,γ>1,工程上称γ为绝热系数。
对于理想气体,C,=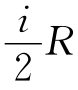 ,C,=
,C,=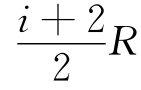 ,则Vmpm
,则Vmpm
以上关于理想气体摩尔热容的讨论,只适用于常温常压下的气体。实验表明,在低温或高压下,气体摩尔热容的测量值与理论值不符,其原因要用量子力学理论解释。






